プラントで化学反応を扱うとき、「この反応ってどう進むんだろう?」と戸惑った経験はありませんか?
化学反応の基本を押さえることは、プロセス設計・安全管理・運転最適化に直結します。
本記事では、化学プラントの現場でよく出てくる反応の種類や、反応速度に関わる要因を、初心者向けにやさしく解説します。
「化学は苦手だけど、現場で役立つことだけ知りたい!」という方にもおすすめの内容です。
乙4(危険物第四類)の範囲内で化学反応について解説します。
化学反応の知識は、化学プラントでは絶対に必要です。有機化学の世界なら分かりにくいですが、無機化学なら割とシンプル。有機化学を扱う工場だとしても、機械系出身者は細かいことまでは知る必要ありません。ここで紹介した内容を知っていれば、運転管理は十分に可能です。
というか、私はこれで実践してきました。
物理変化と化学変化
化学変化とは何でしょうか?
化学変化の対になるのが物理変化です。
物理変化とは例えば以下のような例です。
- 氷が融けて水になる
- バネが伸びる
- 塩を水に溶かして塩水にする
物理的な変化は、物質の温度や圧力を変えることで、物質の状態が変わることを差します。
物理変化とは物質の三態が変わる変態も含まれます。
化学変化は、物質の性質が変わるような変化です。
化学式が変わるような世界です。
- ガソリンが燃えて水と二酸化炭素ができる
- 鉄がさびる
- 水を電気分解させて、水素と酸素を得る
物理変化である氷と水は、性質が変わっているようにも見えるので、化学変化に含まれると考える人もいるでしょう。
ここは「化学式」が変わるかどうか、に着目する方が良いです。
氷も水も同じH2Oですよね。
化合
化合とは2種類以上の物質から、異なる物質を得る化学変化です。
反応式で見る方が分かりやすいでしょう。
A + B → AB
パズルの組み合わせの1つとして考えればOKでしょう。
バッチ系化学プラントでは有機化学をフル活用しますので、機械エンジニア程度ならここの反応の種類を明確に意識する機会はありません。
他の化学変化もパズルの1種です。
化学反応の具体例としては酸化を上げましょう。
C + O2 → CO2
他にも化合に相当する反応はいっぱいあります。
分解
分解は化合の逆と考えればいいでしょう。
化合物が2つ以上の成分に分かれることを分解といいます。
反応式で見てみましょう。
AB → A + B
具体的な例は水の電気分解が良いでしょう。
2H2O → 2H2 + O2
置換
置換は言葉どおり、置き換えることです。
ある化合物の原子が他の原子と置き換わる反応です。
反応式を見ましょう。
AB + C → AC + B
BとCが置き換わっています。
危険物乙4の範囲では、このパズル感覚でOKです。本当はもっと複雑な反応が内部では起こっていますが、気にしなくて良いでしょう。
亜鉛に濃硫酸を加えて、水素を出す例を紹介します。
Zn + H2SO4 → ZnSO4 + H2
複分解
複分解は置換を複数子繰り返すものと考えればいいでしょう。
反応式としては以下のとおり。
AB + CD → AD + CB
BとDがそれぞれ入れ替わっていますよね。
食塩に硫酸を加えて、硫酸ナトリウムを得る反応を紹介しましょう。
2NaCl + H2SO4 → Na2SO4 + 2HCl
何度も書きますが、パズル感覚でOKですよ。
重合
重合は小さな分子量の物質が、繰り返し結合することを言います。
重合には付加重合はと縮合重合があります。
付加とは有機化合物の二重結合や三重結合に原子が結合することを意味します。
縮合とは有機化合物の2つ以上の官能基間の反応で、簡単な分子の離脱を伴って、結合する反応です。
良く分かりませんよね。
重合そのものはペトロケミカル系の世界です。
バッチケミカルの範囲では重合ではなく、付加や縮合という単一の反応として登場します。
付加重合
付加の例として以下を見てみましょう。
CH2CHO + H2 → CH3CH2OH
H2という分子が、結合されているのが分かりますよね
付加重合はこれを繰り返し行います。具体例としてはポリエチレンがあります。
エチレン → ポリエチレン
エチレンはCH2=CH2という構造ですが、この2重結合を解き放つと、重合ができます。
この辺は、有機化学の世界になりますので、詳細は省略します。
縮合重合
縮合の例としては以下を紹介します。
CH3OH + HNO3 → CH3NO3 + H2O
OHとHを取り除いて、結合させていますよね。
この反応の逆反応が加水分解です。
CH3NO3に水を加えることで、CH3OH(メタノール)とHNO3(硝酸)を得ます。
縮合も加水分解も登場する機会は多いです。
縮合重合としてはPETボトルが良い例です。
エチレングリコール + テレフタル酸 → PET +H2O
物質の種類分け
日常生活で物質と呼ぶとき、どんなものをイメージするでしょうか?
石・木・鉄・樹脂・油・・・
これらの呼び方をするとき、その物質を一言で代表していますが、
化学の目で見るとそう単純にはいきません。
混合物
混合物は言葉どおり何種類かの物質が混じったものです。
純物質と混合物という対比構造として混合物は登場します。
物理的な視点で見ています。
空気なら窒素79%と酸素21%のほかにさまざまな物質が混合されたものです。
ここで窒素や酸素が純物質と呼びます。
この概念は、化学プラントの機械屋でもフル活用します。
原料・プロセス液・製品・設備材料あらゆる場面で登場する物が混合物です。
混合物の中にどれだけの純物質が含まれているかを示す用語として「組成」という単語を使いますよ。
当たり前のように見えますが、基本事項なのでしっかりおさえておきましょう。
化合物
化合物は混合物とは違って化学的な視点で見たものです。
単体と化合物という対比構造として化合物は登場します。
水は化合物、水素や酸素は単体という位置づけになります。
これは化学式を見れば分かります。水の化学式はH2Oと書けます。これは化合物です。
HやOはそれぞれ水素や酸素という単体の物質です。
そもそも化合ってA + B → ABという反応のことを言いますよね。
2H2 + O2 → 2H2O
という化合を経て得られた化合物が水ということですね。
化学反応を扱う化学プラントでは取り扱うほぼ全てが化合物です。
機械エンジニアが単体と化合物を意識して仕事をすることはありません。
同素体
同素体は同位体と混乱しがちな種類分けです。
同素だから素材は同じだけど、性質が違うというモノです。
同素体の例として有名なのがダイヤモンドと黒鉛
このどちらも炭素原子が規則正しく並んでいます。
その並び方が変わるだけで、色や硬さなどの性質が変わります。
他にも同素体の例としては下記が有名です。
酸素とオゾン、黄りんと赤りん
なお、同位体は同じ原子番号で中性子数が違うものを差します。
異性体
異性体は分子式が同じでも分子の構造が違うために、性質が変わることを言います。
同素体は原子の並びを見ていますが、異性体は分子の配列を見ています。
異性体は有機化学の世界です。
構造異性体
構造異性体は分子式が同じでも、構造が違うという例です。
C2H6Oという分子式でも、エタノールとジメチルエーテルの2つがあります。
Oがエタノール基-OHであるか、エーテル基-O-であるかで変わります。
この辺は高校化学の問題で出てきそうな内容です。
ベンゼン環がある場合には、官能基の位置づけでオルトo,メタm,パラpと区別されます。
化学プラントの機械エンジニアなら、原料や製品名でこれらの内容が出てくるのを何となく把握する程度でしょう。
知っておくとちょっと嬉しい雑学的なポジションになります。
立体異性体
立体異性体は分子の立体構造が違うために性質が変わるものです。
幾何異性体という二重結合前後の官能基の配置が変わることで性質が変わるものが1つ。
これはシス-トランスという呼び方をします。
トランス脂肪酸などで近年有名になってきています。
この辺りの記事が参考になります。
幾何異性体の他に光学異性体という概念もあります。
これは化学的性質や物理的性質は同じなのに、光学的性質だけが変わるものです。
鏡像の関係にある異性体です。
分かりにくいですよね。
これも構造異性体と同じく雑学の範囲です。
バッチ系化学プラントでは光学異性体が不純物として生成するような反応系はありますので、登場したときにはちょっと嬉しい気持ちになりますね。
物質を構成する要素
物質を構成する要素を紹介します。
化学というよりは物理の世界と考える人もいるでしょう。
ミクロな話題です。
元素
元素とは物質を構成する基本的成分のことです。
元素記号って聞いたことがありませんか?しゅう
メンデレーエフの周期表として有名なアレです。
H,He,Li,Be…って暗記した人も多いでしょう。
周期表に記載されている記号が、元素です。
元素とは単体・混合物における単体と同じ扱いで良いでしょう。
原子と分子
原子とか分子って聞いたことがありますよね。
この辺は、専門用語の数が多くて整理が追い付かない人もいるでしょう。
整理してみました。
原子・電子・原子核
原子って何でしょうか?
元素とほぼ同じ扱いです。
原子とは物質を構成する粒子のこと。
元素が物質を構成する基本的成分で、原子が物質を構成する粒子。
分かりにくいですよね。
原子は電子・原子核とセットで議論するときには、原子という呼び方をします。
下の例を見てみましょう。これはHe(ヘリウム)の原子の構造例です。
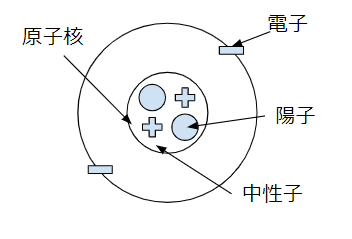
原子は原子核と電子から構成されます。
原子核は陽子と中性子から構成されます。
原子 = 原子核 + 電子 = 陽子 + 中性子 + 電子
原子番号・質量数
メンデレーエフの周期表には原子番号・質量数という数字が記載されています。
Heという原子を例に紹介しましょう。
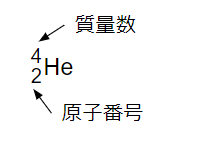
元素記号Heの左下と左上に数字が書いています。
これが質量数と原子番号です。
質量数は陽子の数と中性子の数を合わせたもの。原子核の情報です。
原子番号は陽子の数です。これは通常は電子の数と等しいです。
質量数 = (陽子 + 中性子)の数
原子番号 = (陽子)の数
同位体
同位体は同じ元素でも中性子の数が変わったものです。
下の例を見ましょう。
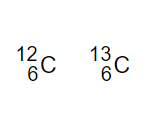
C炭素原子は陽子が6個・中性子が6個が基本です。
ところが同位体として中性子が7個の炭素原子が存在します。
原子番号が同じなら陽子と電子の数は決まっていますが、中性子の数は決まっていません。
同族元素
族とは周期表の列のことです。
族は1~18までの族があります。同じ列にある族を同族といいます。
アルカリ金属・アルカリ度類金属・ハロゲン・希ガスなどが有名です。
これは細かい内容は省略します。
分子
分子は物質の特性を持っている最小単位です、
原子がいくつか組み合わさったものとして考えるのが良いでしょう。
水素原子はHですが、水素分子はH2です。
これは細かい内容は省略します。
イオン
イオンは陽または陰の電気を帯びた原子のことです。
水素原子はHですが、水素イオンはH+です。
これは細かい内容は省略します。
原子価
原子価とはある元素の1原子が水素原子の何個と結合するかを表したものです。
原子中の電子の中でも最外殻と呼ばれる部分に位置する電子の数で、原子の化合の仕方がほぼ決まります。
これは細かい内容は省略します。
原子量と分子量
原子・中性子・電子の高校物理の世界から少し発展させて高校化学の世界にを向けましょう。
原子量
原子量は、原子の質量を簡易的に表記したものです。
原子の質用は非常に小さく、1個の原子は10-22gという小さなものです。
いちいちこれをグラム「g」という小さな世界で議論していると大変。
そこで、考えたのが原子量です。
炭素原子Cの質量数12の同位体を12という基準とします。
Cの何倍の質量であるかで質量の議論をしようということが、都合が良かったようです。
水素の原子量は1、窒素の原子量は14、酸素の原子量は16というように綺麗な数字で表現できます。
分子量
分子量は原子量と比べると良いでしょう。
原子に対して分子です。
水素の分子量はH2だから2(=1×2)、二酸化炭素の分子量はCO2だから44(=12+16×2)です。
式量
式量は分子量とほぼ同じ扱いで使えます。
イオン結晶の場合は分子量ではなく式量と呼びます。
化学当量と呼ぶこともあります。
物質量
高校化学で最初につまづくのがこの物質量。
モル(mol)という呼び方をします。
質量数12の炭素原子12gに腹案れる陽子の数がモルです。
6.02×1023個 = 1mol
単にこういう単位換算をしているだけです。
例えば1億は108のことですよね。
大きな数をまとめて1つの簡潔な呼び方をすると楽だから使います。
物質量もこれと全く同じことです。
molは化学プラントで大活躍します。
化学プラントの生産量を決めるときに、まずはmolで議論します。
化学反応がmolの世界で整理されているからです。
1日当たり何molの製品が得られるか、から1年間に得られる製品量を決め、売上予想ができます。
製品量はkgやtonという重量で議論しますが、化学反応や成績を決める時にはmolの世界でまずは議論します。
質量 = mol × 分子量
という関係があります。
化学式
化学式って何でしょうか?
同素体・同位体などと同じく、定義の種類が多くて混乱しますよね。
化学式とは、元素記号を組み合わせて物質の構造を示す式のことです。
いくつかの種類があります。
分子式
分子式は分子を構成している原子の数を、元素記号の右下に付けた式です。
水素ならH2、二酸化炭素ならCO2
というように書きます。
組成式
組成式は、化合物を構成している原子やイオンの数を、最も簡単な整数比で示すものです。
酢酸はC2H4O2が分子式ですが、組成式ではCH2O
というように整数比が簡単になっています。
化学プラントの機械エンジニアが触れることはありません。
示性式
示性式は、分子式から特定の官能基を抜き出して表した化学式です。
官能基がキーワードで、有機化学の世界で登場します。
酢酸はC2H4O2が分子式ですが、示性式はCH3COOH
と書きます。-COOHという官能基が外出しされている格好です。
構造式
構造式は有機化学で登場する化学式です。
原子の結港の仕方を直線で示しています。
ベンゼン環が亀の甲なんて言われるのもこの構造式の1つです。
化学反応式
化学反応式は機械エンジニアであっても、ちゃんと見れるようになっておきたいです。
化学反応式を使って多少の計算もできるようになれば、エンジニアとしての幅が広がります。
化学反応式は化学式がベースになっています。
化学反応式ってどういうものでしょうか?
化学変化の記事で紹介したものがベースです。
C + O2 → CO2
これは立派な化学反応式。
化学反応式から分かること
化学反応式から分かることを見ていきましょう。
質量保存則が基本にあります。
炭素と酸素から二酸化炭素を得る化学反応式を見てみましょう。

ここで質量が保存されることがポイントです。
炭素原子が1kmolあるので12㎏、酸素分子が1kmolあるので32㎏
得られる二酸化炭素は1kmolあって44㎏
という関係が成立します。
molについては下の記事を確認してください。
マスバランス
質量保存の関係は、気体でも液体でも固体でも成立します。
二酸化炭素の例も、炭素は固体・酸素や二酸化炭素は気体です。
molで整理すれば、反応に必要な重量の関係を知ることができます。
化学プラントでマスバランスというとき、化学反応式に従って整理します。
実際の化学反応は非常に複雑で、多くの不純物を含みます。
化学反応式の左辺側も右辺側も不純物があります。
これらの関係を細かく化学反応式に書くと複雑になり過ぎるので、省略しますが、
副生物や不純物の量的関係を実験等で整理することは、化学プラントの合成ルート探索で非常に大事です。
副生物や不純物の割合が、収率に直結し、製品の競争力に直結するからですね。
反応物がきれいな整数関係よりも、どちらか1つを多く仕込む方が反応が速く進むこともあります。
左辺の係数が整数関係になく、何か1つの原料が1.1や1.2など多めに仕込むことも普通にあります。
これも原料投入量を増やす方向で、原単位が変わるので、変動費として直接影響します。
ヘスの法則と熱化学方程式
ヘスの法則と熱化学方程式を紹介します。
この概念は化学プラントの機械エンジニアでは極めて重要です。
直接意識するエンジニアは少ないですが、少なくとも化学プラントを運転するうえでは極めて重要です。
ヘスの法則
ヘスの法則について紹介します。
ヘスという人の名前で覚えるのは、難しいかも知れませんね。
総熱量不変の法則という方が分かりやすいです。
質量保存の法則と同じで、熱量も保存されます。
炭素を燃焼させて二酸化炭素になる反応を見てみましょう。
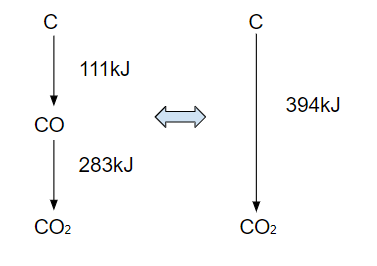
炭素は一酸化炭素を経て二酸化炭素になると左のルート
炭素が直接二酸化炭素になると右のルート
どちらのルートも発生する合計の熱量は変わりません。
これがヘスの法則、総熱量不変の法則です。
熱化学方程式
熱化学方程式を見てみましょう。
熱化学方程式のベースは化学反応式です。
先ほどのヘスの法則で紹介した反応を熱化学方程式で表現しましょう。
左側の2段階ルートの場合は以下の熱化学方程式です。
$$C(固)+\frac{1}{2}O_2(気)=CO(気)+111kJ$$
$$CO(気)+\frac{1}{2}O_2(気)=CO_2(気)+283kJ$$
右側の1段階ルートの場合は以下の熱化学方程式です。
$$C(固)+O_2(気)=CO_2(気)+394kJ$$
化学反応式に似ていますが、微妙に違いますよね
- (固)や(気)という状態が記載されている
- 左辺と右辺が→でなくて=で結びつく
- 熱量がkJで表現
発熱反応が+側、吸熱反応が-側です。
発熱と吸熱
熱化学方程式で発熱や吸熱という単語が出てきましたね。
これは化学プラントで極めて重要です。
発熱反応は絶対に制御
特に発熱反応側。
発熱反応とは熱が発生するため、温度が上がります。
物質の内部に持っていたエネルギーが、反応に伴って外部に熱の形で放出されます。
熱が出ると温度が上がり、温度が上がると暴走反応を起こします。
暴走反応を起こすと、火災爆発が起きて、大事故になります。
化学プラントでは絶対に割けないといけないこと。
温度制御のために溶媒の量・種類、原料の投入方法、冷却制御などのあらゆる対策を講じます。
反応している間は、冷却をし続けないといけません。
停電が起こって冷却ができないと危険な状態になるので、停電対策も必要。
吸熱反応はやや安全
なお、吸熱反応だと外部から熱を供給しないと反応が進みません。
反応が進むと温度が下がるので、温度が下がり過ぎないように熱を加えます。
供給する熱を止めると、温度が下がる方向なので、比較的安全です。
反応熱の種類
反応熱はいくつかの呼び方があります。
- 燃焼熱
- 生成熱
- 中和熱
- 溶解熱
反応にともなって発熱・吸熱が起こるという意味ではどれも同じです。
燃焼熱は化学反応としてはほぼありえなく、ボイラーや燃焼炉などの世界で登場します。
生成熱は化学反応で出てくる反応熱。反応熱というと生成熱を差します。
中和熱は中和で出てくる反応熱。これも化学反応で登場します。
溶解熱は物質を用役に溶かしたときに出る反応熱。これも化学反応で登場します。
中和熱も溶解熱も化学反応で登場する割に、機械・電気・計装エンジニアは感度が鈍いです。
エネルギーという視点で安全な状態ほどエネルギーが低いという認識があれば、
中和で安全な状態へ、溶解をして安全な状態へ、それぞれ移行するというイメージが持てるでしょう。
水と水蒸気
水が水蒸気の関係を発熱・吸熱関係から見てみましょう。
これは蒸発潜熱という呼び方もしますね。
水の蒸発潜熱は100℃で2257kJ/kg
熱化学方程式的には以下のように表記します。
$$H_2O(気)=H_2O(液)-40.6kJ$$
気体の水蒸気から液体の水に変わると熱が発生します。
水蒸気の熱を使って、物を温めるという時は、この蒸発潜熱を使っています。
逆に水を水蒸気にするためには、熱を加えないと移行しません。
気体である水蒸気の方がエネルギーが高いという言い方もできます。
熱化学方程式上はmolで表現するので40.6kJ/molですが、これは簡単にkg単位に変換できます。
40.6kJ/kmo÷18kg/kmol×1000J/kJ≠2257kJ/kg
化学反応速度
化学反応速度は言葉どおり反応速度のことです。
反応速度は化学プラントの運転にとって非常に重要です。
特にバッチ系化学プラントでは反応速度が、生産スケールに直結します。
粒子の衝突
そもそも反応ってどうやって起こるでしょうか?
非常に細かいミクロな視点で見ましょう。
粒子の世界です。
反応物Aの粒子と反応物Bの粒子が接触することで反応は起こります。
出会いが無ければ反応はしません
こう書くとなんだか格好いいですね。
接触というが実際には衝突です。
物質を構成する数多くの粒子が衝突する確率が高い方が、反応は速く進みます。
活性化エネルギーと触媒
活性化エネルギーと触媒について説明しましょう。
バッチ化学反応ではたまに登場する触媒。
これが活性化エネルギーと関連します。
下の図を見てください。
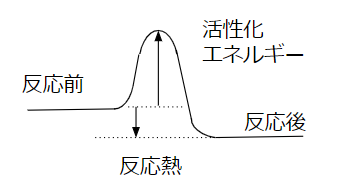
縦軸がエネルギーを示しています。
反応熱は発熱の場合示しています。
反応によってエネルギーが解放されているはずなのに。その途中ではエネルギーが高い山を越えないといけません。
この山を活性化エネルギーと呼んでいます。
活性化エネルギーは一般的な反応に必ずあります。
問題はこのエネルギーの高さ。
活性化エネルギーが高いと、反応を進めるために手を加えないといけません。
例えば温度を上げることも1つ。
ただし温度を上げすぎると暴走反応を起こします。
この活性化エネルギーを低くするために触媒があります。
反応速度への影響
化学反応速度に与える影響を整理しましょう。
温度
温度が高いほど、反応速度は高くなります。
10℃温度が上がると、反応速度は2倍
なんて言われたりします。
これは温度が高い方が、粒子運動が活発だから。
活発に粒子が動く方が、粒子の衝突確率が上がります。
圧力
圧力が高い方が、反応速度が上がります。
これも粒子の衝突確率が上がるから。
圧力が高い方が、粒子の密度が高いからです。
液体同士の反応ではほとんど意味がないですが、気体の反応がある場合は、
圧力を上げると反応速度は上がります。
触媒
触媒があると、反応速度は上がります。
活性化ねルギーが低い反応経路で反応が起こるからですね。
化学平衡とルシャトリエの法則
ルシャトリエの法則と化学平衡について説明します。
化学平衡
化学平衡は化学反応速度に関連します。
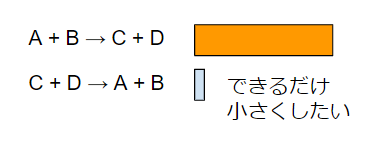
A + B → C +D
という反応があったとします。この反応は裏では
C + D → A +B
という反応も起こっています。正反応・逆反応と呼びます。
正反応と逆反応が同時に起こって、どこかのポイントで落ち着きます。
これを化学平衡といいます。
化学反応を行う場合、正反応を最大化・逆反応を最小化したいと思うのが普通。
一般には、逆反応を押さえたいと思います。
ルシャトリエの法則
ルシャトリエの法則とは、化学平衡の移動の法則です。
化学平衡は、温度・圧力・濃度などの条件が変われば、変化します。
ルシャトリエの法則は、反応条件を変えた時にその変化を打ち消す方向に移動するという法則です
これは平衡条件が変わるということになります。
具体的な条件を変えた時に、ルシャトリエの法則に従うとどうなるかを説明します。
温度
運転温度が上がると、温度を下げようという方向に平衡が移動します。
発熱反応 A + B = C + D + Q kJ の場合、
C + D → A +B側、つまり逆反応に平衡が移ります。
温度が高いために反応速度は上がりますが、生成物が少なくなる側に平衡が移ります。
実際にはこんなに単純な話ではなく、温度が高いために別反応が進んで不純物ができる、という方が正しいです、
圧力
圧力が高くなると、圧力を下げようとする方向に平衡は移動します。
基本的には気体反応のみです。
A + B(気) = C + D
というようにBの気体が反応で消失する反応系が分かりやすいです。
圧力を上げるとはBの圧力を上げることに等しいです。
Bの圧力を上げると、Bの気体量を減らそうとするために、
A + B → C +Dつまり正反応が進むということを意味します。
濃度
濃度は圧力と同じように見れば良いでしょう。
圧力の場合は気体に限定されていますが、濃度は液体にも使います。
圧力を上げると気体の密度が上がるため、気体の濃度を上げるという意味ですからね。
液体でも同じように反応物の濃度を上げると、正反応が進みます。
実際には濃度というよりは物質量そのものが関係します。
溶液
そもそも溶液って何でしょうか?
化学の世界でしか登場しないように見えますが、日常生活でもあふれています。
溶液と溶解
溶液とは溶解した液体のこと。
溶解とは液体に他の物質が溶けていることを言います。
水に砂糖や塩を入れると溶けますよね。これは立派な溶解。
砂糖水や塩水は立派な溶液です。
濃度
溶液の度合いを示す指標に濃度があります。
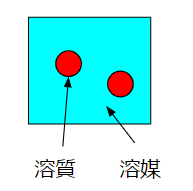
濃度は簡単にいうと
$$\frac{溶質}{溶液}$$
というものです。
砂糖水なら溶質が砂糖、溶液が砂糖水、溶媒が水です
濃度としては質量を基準としたものと体積を基準としたものの2つがあります。
一般的に質量を基準とします。質量は変わりませんからね。
さらにモル濃度・質量モル濃度・グラム当量などの様々な濃度の表現がありますが、
これは無視していいです。
いずれにしろ、濃い・薄いという度合いを濃度というのだから、そんなに複雑に考える必要はありません。
溶液の溶解度
溶液に溶質が溶ける度合いを溶解度といいます。
これは化学プラントでも機械エンジニアは知っておかないといけません。
固体
固体の溶質が液体に溶ける状況を考えましょう。
固体の液体に対する溶解度ですね。
固体の液体に対する溶解度は、液体の温度が高い方が高くなります。
温度が高いほど固体は液体に良く溶けます。
溶解度は溶媒・溶質の種類と温度で決まります。
ある温度でのその溶媒に溶質が溶ける最大量を飽和溶解度と言います。
気体
溶質が固体ではなくて気体の場合を考えましょう。
液体とは逆の現象が起きます。
気体の液体に対する溶解度は、液体の温度が低い方が高くなります。
温度が低いほど気体は液体に良く溶けます。
コーラとかビールを想像すればいいでしょう。
濃度の影響
濃度が溶液に与える影響を紹介します。
沸点上昇
沸点上昇とは言葉どおり、沸点が上昇することです。
水は大気圧下で100℃で沸騰します。
ここに何かが溶けていると沸点が上昇するという性質です。
どんな溶質がどの溶媒に何度の沸点上昇をするか、
ということは個別にデータがあるので、興味があればご自身で調べてください。
沸騰しようとするとき、液体の内部で気体になろうとする力が働きます。
水を沸騰させると、底から気泡が出ますよね。
溶質が溶けているとこの動きを妨げようとします。
そのため通常よりも沸騰しにくくなり、沸点上昇が起きます。
化学プラントでは蒸留と同じ感覚で議論に上がります。
凝固点降下
凝固点降下は沸点上昇の逆です。
凝固点が降下します。
これも溶質が邪魔をするからですね。
塩水が0℃で氷にならないのも凝固点降下を利用しています。
化学プラントではブラインが凝固点降下を利用したものですね。
ラウールの法則
ラウールの法則は沸点上昇や凝固点降下の度合いを直線関係に近似する法則です。
薄い非電解質の溶液では、沸点上昇は
モル沸点上昇 × 質量モル濃度
で決まるというのがラウールの法則です。凝固点降下も同じです。
薄い非電解質というのがポイントです。
濃い溶液だと、沸点上昇は徐々にズレていきます。
電解質だとイオンの数による影響を受けます。
沸点上昇や凝固点降下を計算式で議論することは少なく、
運転に必要なデータを自ら取得していくのが普通です。
参考程度の計算で使う場合がある程度ですね。
中和
酸とアルカリを混ぜることを中和と言います。
この中和について解説しましょう。
酸とアルカリ
酸とアルカリって聞いたことがありますよね。
酸は塩酸・硫酸などが有名で、アルカリはアルカリ乾電池で有名でしょう。
以下の定義で理解してれば十分です。
- 酸 水に溶けると水素イオンH+がでる
- アルカリ 水に溶けると水酸化物イオンOH–がでる
化学反応式では以下が有名ですね
- HCl → H+ + Cl–
- NaOH → Na+ + OH–
酸やアルカリとは、水に溶けることでイオンに分解するような物質とも言えます。
イオンについてはこちらの記事でも登場していますね。
価数と電離度
価数と電離度という概念があります。
これは単なる紹介まで。
化学プラントの機械エンジニアが使うことはほぼありません。
価数は1分子の酸から生じる水素イオンの数です。
電離度は水に溶かした物質のうち、電離した割合です。
酸化物
酸化物についても定義のみ紹介します。
価数・電離度と同じく使う機会はほぼありません。
酸性酸化物は水に溶けて酸性を示すもの、塩基性酸化物は水に溶けて塩基性・アルカリ性を示すもの。
この記事では塩基性とアルカリ性を区別なく同一のものとして扱っています。
塩(えん)と中和
塩は塩です。「えん」と呼びます。
「しお」も実は塩の1つ。
塩(えん)の定義は、簡単に言うと
酸とアルカリが混ぜってできた化合物
これだけです。
この反応を中和と言います。
中和は立派な反応です。下の記事も確認してください。
食塩として有名なNaClも立派な塩の反応です。
HCl + NaOH → NaCl + H2O
他にも酸とアルカリが混ざったものは基本的に塩です。
化学プラントでは、水への溶解度が限定的で「結晶」として析出することも多いです。
pH(水素イオン指数)
pHは水溶液の酸性・アルカリ性の度合いを示すものです。
定義としては以下のとおり。
$$ pH = log\frac{1}{H^+} = -log_{10}[H^+] $$
[H+]や水素イオン濃度です。
[H+][OH–]=10-14(mol/l)2
という関係があります。
この関係から、pHは0~14の範囲内で定義されます。
0~7の範囲が酸性、7が中性、7~14がアルカリ性です。
pH試験紙は液に付けることで、pHの値を知ることができる便利なものです。
1~14までの色の区分とpHの値が一致しています。
酸化・還元
酸化と還元という概念が化学には存在します。
狭義の定義と広義の定義がありますので、まずはそれを紹介します。
狭義の定義
酸化還元の狭義の定義は、以下のとおりです。
- 酸化:物質が酸素と結合すること
- 還元:物質から酸素がなくなること
以下の反応を見てみましょう。
- C + O2 → CO2
- Fe2O3 + 3CO → 2Fe + 3CO2
酸素O以外に着目すると、酸素Oが増えている・減っているという関係がわかりますよね。
酸化還元は1セットです。
酸化だけ・還元だけの反応が単体で成立することはありません。
広義の定義
酸化還元の広義の定義は以下のとおりです。
- 酸化:水素化合物が水素を失うこと・物質が電子を失うこと
- 還元:物質か水素を結合すること・物質が電子を受け取ること
以下の反応を見てみましょう。
- H2S + Cl2 → 2HCl + S
- S + H2 → H2S
この例は水素イオンH+に着目すると、狭義の定義と同じですよね。
酸化が「酸素と化合すること」という略語であることから、狭義の定義を優先しがちですが、
水素や電子に着目する定義もあるというのがポイントです。
実は酸素も水素も電子のやり取りという意味で同じなのですが・・・。
酸素イオンがO2-、水素イオンがH+ですからね。
元素
元素の分類を紹介します。
元素って化学の世界の話ですよね。
数が多いので分類していくところから入ります。
これが好きな人は化学に向いています。
逆に物理が得意な人は、こういう仕分けが苦手な傾向にあります。
化学プラントの機械屋の仕事では、元素について詳しい知識が無くても仕事は可能です。
ただし、化学の仕事をするのであれば、周辺知識として知っておいた方がいいでしょう。
金属元素と非金属元素
元素の分類は1種類の方法だけに限定されません。
いくつかの方法で分類できます。
この1つが金属元素と非金属元素
金属というと鉄系、非金属というとセラミックなどを想像しますよね。
元素の分類上での金属は鉄やセラミックとの分類とは微妙に違います。
金属元素は陽イオンになりやすく、非金属元素は陰イオンになりやすい性質があります。
金属元素と非金属元素の中間にあるものを両性元素と言います。
金属と非金属の一般的な性質を比較してみました
| 金属 | 非金属 |
| 塩基性酸化物を作る | 酸性酸化物を作る |
| 無機酸に溶ける | 無機酸に溶けない |
| 常温で固体 | 常温では固体・液体・気体さまざま |
| 融点が高い | 低温で気体が多い(融点が低い) |
| 比重が大きい | 比重が小さい |
| 熱や電気を通す | 熱や電気を通さない |
| 伸びやすい | もろい |
なお、金属の比重が4以上の物を重金属、4以下の物を軽金属と言います。
鉄は7.87なので重金属、アルミニウムは2.7なので軽金属です。
残念ですが、化学プラントの機械屋としては使う機会はないでしょう。
典型元素と遷移元素
典型元素はメンデレーエフの周期表の1族・2族・12~18族と言います。
遷移元素は3~11族を言います。
典型元素では族番号の下1桁の数字が、陽子の価電子の数に一致します。
族が異なると性質が大きく変わります。
遷移元素は陽子の価電子が1~2個です。
これも残念ですが、化学プラントの機械屋としては使う機会はないでしょう。
アルカリ金属・アルカリ土類金属
周期表の1族元素をアルカリ金属、2族元素をアルカリ土類金属と言います。
アルカリ金属には水素を含まず、アルカリ土類金属にはベリリウムとマグネシウムを含みませんが、この辺りは機械屋は知っていなくても良いでしょう。
アルカリ金属やアルカリ土類金属は陽イオンになりやすいです。
水と反応して塩基性を示します。
典型例がNa。
NaOHが苛性ソーダとして有名です。
CaやKなども同じく塩基性を示します。
ハロゲン
ハロゲンは17族に属する元素です。
フッ素・塩素・臭素・ヨウ素です。
アルカリ金属・アルカリ土類金属とは逆に、陰イオンになりやすいです。
ハロゲンの単体はいずれも有毒です。
取扱は極めて慎重にしないといけません。
バッチ系化学プラントの機械屋でも塩素や臭素を扱うケースは多いでしょう。
設備そのものよりも配管やガスケットなどに気を使います。
イオン化傾向
イオン化傾向は陽イオンへのなりやすさを並べた物です。
K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > Cu > Hg > Ag > Pt > Au
丸暗記した人もいるでしょう。
化学プラントの機械屋としては、これを丸暗記する必要はありません。
そもそも使う機会があまりなくて・・・
Zn > Fe > H
これだけ知っていれば十分です。
このイオン化傾向ですが、アルカリ金属・アルカリ土類金属が比較的高いことに気が付くでしょう。
有機化学
有機化学は最低限の理解はしておきたいです。
化学を知らない人から見ると、有機化学というだけで非常に幅広く奥深い分野に見えます。
亀の甲がいくつも重なった良く分からないモノ
こういう印象が先行して、毛嫌いする人が非常に多いです。
それを認識していながら、有機化学に詳しい人は一般には無意識に権威性を出そうとしがちです。
これが化学を知らない人には、さらに毛嫌いする要因になってしまいます。
結果として、化学に興味を持ち化学会社に入社する人が少なくなる一因となるのですが、
そこまで意識して化学をしている人はほぼいないでしょう。。。
危険物乙4や化学プラントの運転をするうえで、機械エンジニアや化学を勉強したことがない人にでも、最低限知っておきたい部分に絞って解説します。
有機化合物は炭素が主役
有機化合物は炭素が主役の物質です。
有機・無機というのは炭素があるかないかという意味です。
一酸化炭素や二酸化炭素を除いた炭素の化合物を有機化合物と言います。
炭素C以外に、水素H・酸素O・窒素Nなどを組み合わせたものです。
実は人間もほとんど有機化合物でできています。
油も有機化合物。樹脂も有機化合物。
身の回りに有機化合物は非常に多いですよ。
燃えると水と二酸化炭素が出る
有機化合物で最初に抑えたいことは「燃えやすい」ということ。
化学プラントでは危険物として最も恐れるべき性質です。
化学プラントでは化学反応のために有機溶媒を大量に扱うことが普通。
それが燃えると大事故に繋がります。
当たり前のように見えますが、絶対に抑えたい事象です。
有機化合物は燃えると水と二酸化炭素が出ます。
炭素と水素と酸素で構成されているからですね。
水に溶けない
有機化合物は水に溶けません。
水と油という言葉があるとおり、水に溶けません。
一部の有機化合物は水に溶けますが、それは例外的なものです。
とはいえ、化学プラントでは水にも油にも溶ける有機溶媒をフル活用しますけどね。
メタノールとかアセトンが良い例です。
電気を通さない
有機化合物は電気を通しません。
水は電気を通すことで有名ですけど、油は電気を通しません。
あまり意識することはありませんが、化学プラントでは極めて大事です。
化学プラントでは静電気による有機化合物の着火が最も恐ろしいからですね。
水が電気を通し、油が電気を通さないという性質を利用して、バッチ系化学プラントでは水と油を分離するために導電率計を活用します。
構造が複雑
有機化合物は構造が複雑です。
炭素・水素・酸素などから組み合わせるのが有機化合物。
元素の種類は少ないですが、結合方法は無数にあります。
アルカリ金属・アルカリ土類金属・ハロゲンなどの元素は種類が多いですが、結合方法は少ないです。
| 項目 | 有機 | 無機 |
| 元素数 | 少ない | 多い |
| 結合種類 | 多い | 少ない |
結合種類の数だけ種類があり、有機化学を複雑にしています。
有機化合物は種類がほぼ無制限にあるので、
化学の可能性は無限大
などと言われますよね。実際にはかなり言い過ぎなのですけど^^
有機化合物は分類や官能基がいくつもあります。
この種類の多さが有機化学から遠ざかる人を増やす要因の1つ。
この記事ではその種類をラインナップする程度に留めます。
これらの情報は。機械エンジニアにはほとんど関係のない情報です。
有機化合物の構造としては以下のような分類があります。
- 鎖式化合物・環状化合物
- 飽和化合物・不飽和化合物
- 油環式化合物・芳香族化合物
有機化学の官能基としては以下のようなものがあります。
- メチル基
- ヒドロキシル基(アルコール、フェノール)
- アルデヒド基
- カルボキシル基
- カルボニル基(ケトン)
- ニトロ基
- アミノ基
- スルホン基
- フェニル基
多いですよね。
全部を知る必要なんてありませんよ。
バッチ系化学プラントではケトン基を知っているだけで十分です。
日常生活ではアルデヒドがお酒と関係することを知っていれば十分です。
参考
忙しいけど勉強したいという場合には、以下のような講座がおすすめです。
関連記事
さらに知りたい方は、以下の記事をご覧ください。
最後に
化学反応の基礎は、少しとっつきにくく感じるかもしれませんが、現場で頻出する反応の「種類」と「進み方」を押さえるだけでも、設計・運転の見方が一気に変わります。
反応速度や触媒の役割など、重要なポイントを理解することで、化学プラントの仕事がもっと「見える化」されていきますよ。
高校の化学で学ぶ範囲のことですが化学プラントでは絶大な効力を発揮します。
化学プラントの設計・保全・運転などの悩みや疑問・質問などご自由にコメント欄に投稿してください。(コメント欄はこの記事の最下部です。) *いただいたコメント全て拝見し、真剣に回答させていただきます。
この記事の内容を、あなたの職場・キャリアに合わせて整理したい方に技術・キャリア相談を行っています。海外プラント、製造管理、組織の病理、キャリア停滞など、あなたの状況に合わせて具体的にアドバイスします
→ 技術・キャリア相談はこちら
【著者:ねおにーーと】
化学プラントで20年以上、設計→製造→保全→企画まで一気通貫で経験したユーザー側エンジニア。 バッチプラントの設備・運転・トラブル対応を中心に、現場で本当に役立つ知識を発信しています。 → 詳しいプロフィールはこちら


コメント