蒸留について解説します。化学プラントならどこでも行う蒸留
バッチプラントと言えども蒸留は実施します。
化学工学に慣れていない機電系エンジニアが、戸惑う1つの分野です。
そこで数式や線図を使わずに起こっていることが何となくイメージできるように、解説したいと思います。
この記事は、蒸留シリーズの一部です。
水蒸気蒸留と真空ポンプ蒸留の違いとは?設備コスト・サイズ・動力コストを徹底比較
【貧溶媒】晶析の前に蒸留が必要な理由
蒸留で省エネ・コスト削減!化学プラントでの溶媒回収の実務解説
水蒸気蒸留の基本計算イメージ|手計算で確認する装置運転の考え方
水蒸気蒸留のかんたんな計算イメージ
バッチ蒸留の基礎と装置構成|反応器・塔・熱交・槽を理解する
蒸留は分離
蒸留とは化学工学的には分離という操作になります。
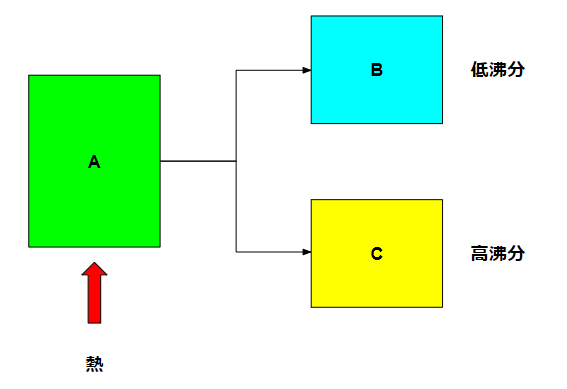
例えばAという液体があって、そこにはいくつかの成分が混じっている混合物であるとします。この中の特定の成分を分離する操作として、蒸留があります。分離するために液体の沸点を利用しています。
液体にはそれぞれ異なる沸点があり、例えば大気圧下で水なら100℃で沸騰しますが、メタノールなら65℃で沸騰します。液体の中にいくつかの成分が混じっている場合に、熱を加えた場合には沸点の低い物質(低沸分)から先に蒸留します。
沸騰したガスを熱交換器などで凝縮させれば、液体として取り出すことが可能です。沸騰して途中のどこかで止めれば、低沸分が多い液体Bを取り出すことができて、残ったCは高沸分が多い液体となります。
蒸留で組成が変わる
化学工学的には蒸留は上記のような、低沸分や高沸分という説明をしますが、もう少しイメージで理解できるようにしようと思います。
組成を簡単に表現してみましょう。液体Aが以下のような5つの液体が混じったものだとします。その割合が以下のグラフの場合を考えます。
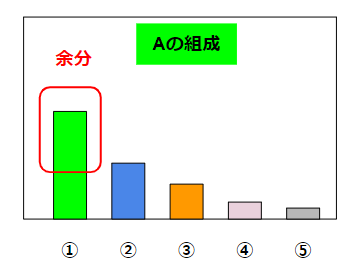
①が最も成分が多く、最も沸騰しやすい低沸分だとします。化学プラントではこういう状況は割とあります。化学に詳しくない人からみると、1種類の液体だけが存在しているように見えますが、複数の液体が混じっていることの方が普通です。大抵は①が圧倒的に多くて、②~⑤はとても小さい量ですが、そこを無視できません。
こういう液体Aの中から①をある程度取り除きたいという時に、蒸留をします。
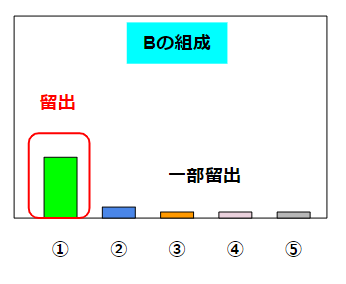
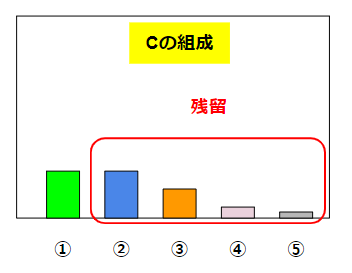
この場合、沸騰して得られる液体Bには①が割合としては大量に含まれています。②~⑤の量はかなり少ないです(それでもゼロではありません)。残った液体Cは①がかなり少なくなって、②~⑤はかなり残っているような割合になります。
これが蒸留で起こっていることです。分離という操作なので、全体の重量は変わりません(A=B+C)。したがって、BもCもAよりは量が少なくなります。その代わり組成(濃度)が変わります。
時間で組成が変わる
蒸留で注意したいことが時間です。沸騰しだした瞬間のBの組成は以下のような状況が考えられます。
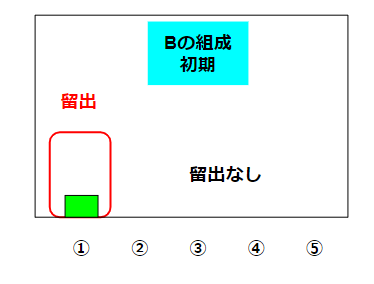
①の量は少ないですが、②~⑤は無視可能な量しかありません。こういうシビアな状態の液体を望む場合には、蒸留の序盤の液体だけを特別に取り除いたりします(初留と呼んだりします)。蒸留の時間を伸ばしていくと、液体Bの中の①の量は増えていきますが、②~⑤の量も増えてきます。
液体Aを完全に蒸発させてしまうと、液体Cは存在せず、液体Bには液体Aと同じものができてしまいます。一般には、液体Aには液体だけでなく固形分を含むので、完全に蒸発させることはできません。
液体Bと液体Cのどちらが製品?
蒸留をして液体Bと液体Cを得るということは、片方が製品として使うもので、他方が廃棄するものが一般的です(まれに両方とも製品として使うこともありますが)。この場合、液体Bが製品となる場合もあれば、液体Cが製品となる場合もあります。
連続だから、バッチだからといった生産方式での明確な区分はありません。バッチの場合は液体C側の方が製品である確率が高いかなという感じはします。
この場合は液体Bを廃棄するか回収するかという選択が生まれますが、溶媒を蒸発させて回収させるという場合が特に多いです。
参考
蒸留は化学プラントでとても重要な工程ですので、本記事でイメージをつかんだ後は以下のような本で是非とも勉強を進めていってください。
関連記事
蒸留についてさらに知りたい方は、以下の記事をご覧ください。
最後に
蒸留で起こることをざっくり解説しました。
化学工学的な計算は使わずに、液体の組成がどう変わるかが大事です。
液体の組成とその割合が変わるということが分かれば、蒸留の結果がイメージしやすいでしょう。
バッチの場合は溶媒回収として蒸留をすることが多いです。
化学プラントの設計・保全・運転などの悩みや疑問・質問などご自由にコメント欄に投稿してください。(コメント欄はこの記事の最下部です。)
*いただいたコメント全て拝見し、真剣に回答させていただきます。


コメント